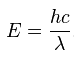¿Cuál es la máxima longitud de onda de un fotón necesaria para ionizar un átomo de Hidrógeno?
 Cuanto más grande la longitud de onda, menor la frecuencia, menor la energía. El átomo de hidrógeno es ionizado por fotones en la frecuencia de los ultravioletas, invisibles y de alta energía.
Cuanto más grande la longitud de onda, menor la frecuencia, menor la energía. El átomo de hidrógeno es ionizado por fotones en la frecuencia de los ultravioletas, invisibles y de alta energía.
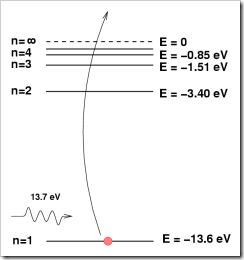
La energía necesaria para ionizar un átomo de Hidrógeno es 1312 kJ/mol. Para calcular la energía necesaria para ionizar un átomo, hay que dividir por el número de Avogadro que es la cantidad de átomos por mol. Entonces:
E = 1.312*10^6 J/mol / 6.022*10^23 átomos/mol = 2.179*10^-18 J/átomo. (13.6 eV)
De la fórmula de energía del fotón respecto de su longitud de onda
donde h es la constante de Planck (6.626*10^-34 kg.m^2/s) y c la velocidad de la luz y λ la longitud de onda, resulta:
λ = (2.998*10^8 m/s) * (6.626*10^-34 (kg*m^2)/s)/(2.179*10^-18 J) = 9.118*10^-8 m = 91.18 nm
 Solo para Entendidos
Solo para Entendidos